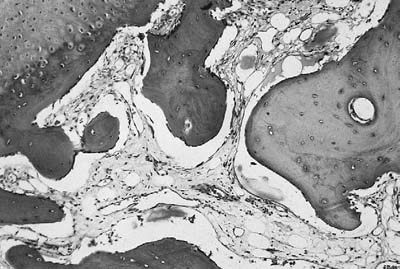
Peu de travaux sont disponibles concernant le domaine anatomopathologique de l’atteinte des enthèses périphériques des SpA, et ce en raison d’obstacles que nous avons déjà signalé en introduction. Il n’existe en particulier qu’uneétude de ces lésions dans des formes précoces de la maladie, ne portant que sur quelques cas [31]. Ainsi, les travaux de John Ball sont toujours ceux qui ont apporté les principales informations actuellement disponibles sur le sujet [10]. La première constatation issue de ces travaux est qu’un foyer d’enthésite dans la spondylarthrite ankylosante est en fait un ensemble de microfoyers, à des stades inflammatoires différents les uns des autres, et séparés par des zones « saines » (Fig. 2).
Références :
[10] Ball J. Enthesopathy of rheumatoid and ankylosing spondylitis. Ann Rheum Dis 1971;30:213–23.
[31] McGonagle D, Marzo-Ortega H, O’Connor P, Gibbo W, Hawkey P, Henshaw K, et al. Histological assessment of the early enthesitis
lesion in spondyloarthropathy. Ann Rheum Dis 2002;61:534–7.
C’est ce qui explique la grande variabilité des lésions d’un endroit à l’autre d’une coupe histologique d’une même enthèse inflammatoire. La deuxième grande constatation est que la lésion inflammatoire initiale semble être un foyer osseux sous « chondral » érosif. Ceci est en accord avec des corrélations radiologiques qui ont effectivement montré que l’érosion, de petite taille habituellement, semble bien être effectivement la lésion initiale de l’enthésite. Il apparaît de plus que les cellules inflammatoires présentes dans ces microfoyers sont de façon prédominante des lymphocytes et des plasmocytes même si dans certains de ces foyers des polynucléaires neutrophiles peuvent être observés. Déjà en 1970, John Ball décrivait des anomalies des espaces médullaires immédiatement sous jacents à la lésion, pouvant être assimilées à des foyers d’ostéomyélite subaiguë ou chronique : ces foyers étaient en effet oedémateux, pauvres en tissu hématopoïétique et lymphoplasmocytes, plus ou moins fibreux. Enfin, l’évolution de ces lésions érosives se fait vers une « cicatrisation » consistant en l’apposition d’os réactionnel au sein d’un tissu conjonctif fibreux sans précession par la formation de cartilage [10]. Pour certains auteurs, l’ossification se ferait plutôt selon un mode endochondral [32]. Cet os nouveau a tendance à remplir le défect osseux initial, joignant l’os plus profond à la terminaison érodée du ligament, formant ainsi une nouvelle enthèse en relief par rapport à l’enthèse initiale [10].Au total, chaque foyer inflammatoire au sein d’une enthèse périphérique semble évoluer pour son propre compte en suivant la séquence : érosion, fibrose, ossification [10]. D’autres travaux sont venus par la suite confirmer ces aspects d’enthésite périphérique [1,33]. John Ball s’est également intéressé aux lésions rachidiennes de la spondylarthrite et, à la lumière de ses résultats et de constatations faites antérieurement, il a pu rapprocher les lésions inflammatoires de l’insertion discale antérieure dans les plateaux vertébraux à ces lésions enthésitiques périphériques [10]. Ainsi, l’érosion initiale correspond radiologiquement au classique aspect de « spondylite érosive antérieure de Romanus » et l’ossification est à l’origine du syndesmophyte [10]. De plus, des lésions également de type « enthésite périphérique » sus décrites ont été observées isolément au sein d’insertions de capsules articulaires postérieures, associées à des processus d’ossification capsulaire, suggérant qu’un des mécanismes de l’atteinte articulaire postérieure dans la spondylarthrite soit bien l’enthésite capsulaire [10]. L’atteinte sacro-iliaque quant à elle semble de mécanisme plus complexe et ne peut manifestement pas être réduite à une atteinte primitive des enthèses de cette région [20]. En effet, une étude a récemment montré que l’atteinte inflammatoire précoce de la moelle osseuse sous-chondrale et de la synoviale explique mieux les lésions constituées de la sacroiliite fusionnante [34].
Pour aller plus avant dans la compréhension des mécanismes de l’enthésite dans les SpA, des études immunohistologiques semblent indispensables. À notre connaissance, seules deux études de ce type ont été publiées, conservant néanmoins certaines limites ne permettant pas de conclusion définitive. La première s’est intéressée à la description quantitative des principaux types cellulaires présents dans des enthèses périphériques de patients atteints de SpA comparativement à la polyarthrite rhumatoïde et à l’arthrose [1]. Elle a mis en évidence que l’infiltrat inflammatoire prédomine dans la moelle osseuse sous-enthésique, et est principalement constitué de lymphocytes T, ceux-ci étant majoritairement CD8+ [1]. Cependant, cette étude a porté sur des maladies de longue durée d’évolution, et sur des fragments prélevés en peropératoire en des sites standardisés donc sans notion d’enthésite clinique ou d’imagerie [1]. La deuxième étude a l’avantage d’avoir porté sur des affections de début récent, avec une confirmation par imagerie (IRM et échographie) de l’inflammation de l’enthèse [31]. Elle a l’inconvénient d’avoir porté sur des fragments de petite taille car obtenus par biopsie à l’aiguille, ne permettant donc pas l’étude de la moelle, et de porter sur peu de cas (5 patients et 2 contrôles). On retiendra tout d’abord l’augmentation de la vascularisation dans les biopsies des patients, ainsi qu’un infiltrat inflammatoire essentiellement constitué de macrophages dans ces lésions enthésitiques jeunes [31]. Ces données sont donc actuellement trop parcellaires pour permettre une synthèse sur la nature des cellules réellement impliquées dans les étapes de l’enthésite.
7.2. Physiopathologie
La physiopathogénie des spondylarthropathies est encore mal comprise comme en témoigne les nombreuses hypothèses différentes détaillées dans la littérature [35,36]. Ces hypothèsesessayent toutes d’intégrer à des degrés divers l’interaction du système immunitaire avec l’allèle HLA B27, certains organismes bactériens et la muqueuse intestinale. Nous ne reviendrons pas sur ces hypothèses physiopathogéniques générales pour nous focaliser sur les principales hypothèses actuellement circulantes concernant la prédilection de l’atteinte des enthèses dans ces rhumatismes. En effet, quel que soit le mécanisme immunogénétique évoqué à l’origine d’une réaction inflammatoire, il faut expliquer comment cette inflammation va se développer avant tout dans certains sites de l’organisme, dans le cas présent dans les enthèses. Une des explications avancées accorde un rôle très important au stress mécanique présent dans la région des enthèses [37,38]. Nous avons vu à quel point les enthèses étaient effectivement des sites soumis à des forces mécaniques itératives. Or, certains travaux récents permettent d’envisager un lien entre un stress mécanique et une inflammation (dans [37,38]). Ceci amène bien entendu à reconsidérer notre conception classique opposant systématiquement les pathologies mécaniques aux pathologies inflammatoires. Il a ainsi été mis en évidence que le stress mécanique était capable d’induire l’expression de nombreux gènes dont celui de certaines cytokines et de molécules d’adhésion [38]. Cette expression génique pourrait passer avant tout par une stimulation du NFj-B sous l’effet du stress mécanique. Le stress mécanique peut également induire de véritables microtraumatismes, ceux ci étant responsables de phénomènes de cicatrisations locaux. Or, il a également été montré que ces deux phénomènes s’accompagnaient de l’activation de nombreux facteurs dont des cytokines tel que l’IL1, le TNF-a, l’IL8, et le TGF-b [38]. L’autre élément pris en compte par ces mêmes auteurs est celui des composants bactériens [37,38]. En effet, même si la présence de bactéries viables n’a jamais formellement pu être démontrée au sein d’articulations de patients atteints de spondylarthropathie, la présence de composants bactériens a été rapportée. Or des travaux récents montrent que ces composants bactériens sont susceptibles de déclencher une réponse inflammatoire locale [38]. Il est donc envisageable qu’une défaillance ou une
variante génétique du système immunitaire facilitant la diffusion de composants bactériens puisse permettre la nidation de ceux ci à distance des sites de pénétration dans l’organisme avec induction d’une réaction inflammatoire locale. Notons que la présence de ces composants bactériens n’a pas été mise en évidence dans les enthèses mais que ceci paraît envisageable pour des raisons d’ordre essentiellement vasculaire : tout d’abord les microtraumatismes augmentent la vascularisation locale, ensuite la circulation de type terminale observée dans l’enthèse pourrait favoriser l’arrêt ou le dépôt d’antigènes dans ces sites [38]. Ainsi, cette hypothèse pourrait expliquer qu’une variation immunitaire, telle que la présentation anormale d’un peptide bactérien par la molécule HLA B27, puisse entraîner une réaction inflammatoire diffuse à bas bruit, celle-ci ne s’exprimant réellement que dans des sites soumis à des stress mécaniques très particuliers favorisant « l’éruption » inflammatoire, éventuellement favorisée également par l’accumulation d’antigènes bactériens dans ces sites anatomiques.
La deuxième grande hypothèse développée dans ces dernières années fait appel essentiellement à un mécanisme auto-immun [39]. Les auteurs pointent tout particulièrement le fait que de nombreux arguments sont en faveur d’un rôle primordial de l’os lui-même dans les symptômes et les lésions des spondylarthropathies [39]. Les anomalies osseuses radiologiques et scintigraphiques des spondylarthropathies sont connues depuis longtemps [40]. Des travaux histologiques, comme nous l’avons rappelé plus haut, ont bien mis en évidence cette ostéite oedémateuse et inflammatoire, ou ostéomyélite, siégeant immédiatement sous l’enthèse ou sous le cartilage de la sacro-iliaque [21]. Enfin, plus récemment, des études IRM ont visualisé un oedème osseux diffus, très fréquent, autour des foyers inflammatoires des spondylarthropathies, qu’il s’agisse des enthèses des sacro-iliaques [41], ou des articulations périphériques [22]. Certains travaux histologiques ou d’IRM vont même jusqu’à suggérer que l’atteinte inflammatoire de la moelle osseuse est la lésion primitive des spondylarthropathies plutôt que l’enthésopathie, qui serait en fait consécutive à l’ostéomyélite sous
jacente (dans [39]). Il se pourrait donc qu’une réaction autoimmune prenne naissance dans la moelle osseuse dirigée contre les composants tissulaires immédiatement en contact avec elle, à savoir le fibrocartilage de l’enthèse et le cartilage articulaire [40]. Il a de plus été montré que d’autres sites cibles de l’inflammation des spondylarthropathies tels que la paroi initiale de l’aorte et la partie fibreuse centrale du coeur contenaient également un fibrocartilage (dans [40]). Un certain nombre de faits expérimentaux viennent étayer cette hypothèse de maladie auto-immune dirigée contre des composants cartilagineux. Parmi ceux-ci, nous retiendrons la mise en évidence chez des patients atteints de spondylarthrite ankylosante de mécanismes d’immunité cellulaire vis-à-vis de protéoglycanes du cartilage [42], et le développement par certaines équipes d’un modèle murin de spondylarthrite, où la maladie est induite par le principal protéoglycane du cartilage, l’aggrécane (dans [43]). Ainsi cette vision physiopathogénique des spondylarthropathies en fait une maladie auto-immune dirigée contre certains composants du cartilage, sous-tendue par le terrain génétique [39,43]. Ceci donne du poids au concept d’enthèse proposé par certains et discuté plus haut, incluant toutes les zones de jonction non seulement entre le fibrocartilage et l’os mais également entre le cartilage et l’os [20,23]. Cette vision n’exclue pas celle abordée préalablement, puisque l’on peut très bien considérer que des mécanismes inflammatoires locaux déclenchés par un stress mécanique ou des composants bactériens favorisent la réaction inflammatoire d’origine auto-immune ou favorisent l’auto immunité elle-même [44].
Références :
[1] Laloux L, Voisin MC, Allain J, Martin N, Kerboull L, Chevalier X, et al. Immunohistological study of entheses in spondyloarthropathies: comparison in rheumatoid arthritis and osteoarthritis. Ann Rheum Dis 2001;60:316–21.
[10] Ball J. Enthesopathy of rheumatoid and ankylosing spondylitis. Ann Rheum Dis 1971;30:213–23.
[20] François RJ, Braun J, Khan MA. Entheses and enthesitis: a histopathologic review and relevance to spondyloarthritides. Curr Opin
Rheumatol 2001;13:255–64.
[21] Shichikawa K, Tsujimoto M, Nishioko J, Nishibayashi Y, Matsumoto K. Histopathology of early sacroiliitis and enthesitis in ankylosing spondylitis. In: Ziff M, Cohen SB, editors. Advances in Inflammatory Research: The Spondylarthropathies, 9. New York: Raven Press; 1985.
[22] McGonagle D, GibbonW, O’Connor P, Green M, Pease C, Emery P. Characteristic magnetic resonance imaging entheseal changes of knee synovitis in spondylarthropathy. Arthritis Rheum 1998;41:694–700.
[31] McGonagle D, Marzo-Ortega H, O’Connor P, Gibbo W, Hawkey P, Henshaw K, et al. Histological assessment of the early enthesitis
lesion in spondyloarthropathy. Ann Rheum Dis 2002;61:534–7.
[32] Fassbender HG. Pathological aspects and findings of Bechterew’s sundrome and osteoarthropathia psoriatica. Scand J Rheumatol
1979(suppl 32):50–60.
[33] Paolaggi JB, Durigon M, Pie Pou P, Struz P, Le Parc JM. Étude anatomopathologique des enthésopathies des spondylarthropathies
inflammatoires. Rev Rhum 1987;54:249–53.
[34] François RJ, Gardner DL, Degrave EJ, Bywaters EG. Histopathologic evidence that sacroiliitis in ankylosing spondylitis is not merely enthésites. Arthritis Rheum 2000;43:2011–24.
[35] Sieper S, Braun B. Pathogenesis of spondylarthropathies. Persistent bacterial antigen, autoimmunity or both? Arthritis Rheum 1995;38: 1547–54.
[36] Berthelot J-M, Glemarec J, Guillot P, Laborie Y, Maugars Y. New pathogenic hypotheses for spondyloarthropathies. Joint Bone Spine 2002;69:114–22.
[37] McGonagle D, Emery P. Enthesitis, osteitis, microbes, biomechanics, and immune reactivity in ankylosing spondylitis. J Rheumatol 2000: 2302–4.
[38] McGonagle D, Stockwin L, Isaacs J, Emery P. An enthesitis based model for the pathogenesis of spondyloarthropathy. Additive effects of microbial adjuvant and biomechanical factors at disease sites. J Rheumatol 2001;28:2155–9.
[39] Maksymowych W. Ankylosing spondylitis. At the interface between bone and cartilage. J Rheumatol 2000;27:2295–301.
[40] Gaucher A, Péré P, Régent D, Grandhaye P, Aussedat R, Vivard T. Spondylarthropathies or ossifying polyenthesitis. Scintigraphic and scanographic evidence. Rev Rhum 1987;54:243–8.
[41] Bollow M, Braun J, Hamm B, Eggens U, Schilling A, König H, et al. Early sacroilitis in patients with spondyloarthropathy: evaluation with dynamic gadolinium enhanced MR imaging. Radiology 1995;194: 529–36.
[42] Mikecz K, Arzoumanian A, Poole AR. Isolation of proteopglycanspecific T lymphocytes from patients with ankylosing spondylitis.
Cell Immunol 1988;112:55–63.
[43] Poole AR. The histopathology of ankylosing spondylitis: are there unifying hypotheses? Am J Med Sci 1998;316:228–33.
[44] Fournié B. Pathology and clinico-pathologic correlations in spondylarthropathies. Joint Bone Spine 2004 (in press).
