Étude d’une cohorte régionale
Revue du Rhumatisme n°72 (2005), Page 650 – 655
- Hélène Maillard (a)
- Paul Ornetti (a)
- Laurent Grimault (b)
- Jean-François Ramon (c)
- Sylvie Melac Ducamp (d)
- Tahar Saidani (e)
- Christian Tavernier (a)
- Jean Francis Maillefert (a)(f)(*)
- (a) Service de rhumatologie, CHU Dijon, hôpital général, 3, rue du Faubourg-Raines, 21000 Dijon, France
- (b) Service de rhumatologie, CH Mâcon, France
- (c) Service de médecine, CH Avallon, France
- (d) Service de médecine B, CH Nevers, France
- (e) Service de médecine IV, CH d’Auxerre, France
- (f) Inserm/ERIT-M 0207, université de Bourgogne, France
Reçu : le 15 juin 2004
Accepté : le 4 septembre 2004
Disponible sur internet : le 21 octobre 2004
Severe pyogenic infections in patients taking infliximab. A regional cohort study
1. Résumé
(version en anglais plus bas)
Objectif
Apprécier la prévalence des infections sévères à pyogènes chez les patients traités par infliximab en pratique courante, et essayer de dégager des facteurs favorisants.
Méthodes
Étude portant sur une cohorte de patients traités dans un réseau régional par infliximab pour polyarthrite rhumatoïde ou spondylarthrite ankylosante, et suivis de façon prospective à l’aide d’une feuille de recueil des données standardisée. Les observations des patients ayant présenté une infection grave à pyogène ont été analysées, et comparées à celles des autres patients.
Résultats
La cohorte comportait 83 patients (55 femmes et 28 hommes), dont cinq (6 %) ont présenté une infection sévère à pyogène (3 femmes et 2 hommes). Ces cinq patients présentaient tous un facteur de risque ou un terrain favorisant. L’âge moyen (65,8 ± 12 vs 53,9 ± 13 ans, p = 0,04) et la dose journalière de corticoïdes (15,5 ± 9 vs 6,9 ± 7 mg d’équivalent prednisone par jour, p = 0,036), étaient plus élevés chez ces cinq patients que chez les autres sujets.
Conclusion
Les infections sévères à pyogène survenant sous infliximab se développent plus facilement chez les patients âgés, et co-traités par des doses importantes de corticoïdes. En conséquence, il convient d’être particulièrement vigilant dans les indications thérapeutiques, et dans la surveillance, chez ce type de patient. Ce travail met également en exergue la nécessité de lutter contre le risque de banalisation du traitement.
© 2004 Elsevier SAS. Tous droits réservés.
2. Abstract
Objective
To evaluate the prevalence and risk factors of severe pyogenic infections in rheumatology patients taking infliximab in everyday practice.
Methods
Regional prospective cohort study of patients taking infliximab for rheumatoid arthritis or ankylosing spondylitis with data collection on standardized forms. The medical records of patients with severe pyogenic infections were subjected to a detailed retrospective review. Patients with and without severe pyogenic infections were compared.
Results
The cohort included 83 patients (55 women and 28 men). Severe pyogenic infections occurred in 5 (6%) patients (3 women and 2 men), all of whom had acute or underlying risk factors. Higher values were found in these 5 patients for mean age (65.8 ±12 vs. 53.9 ±13 years, P=0.04) and mean daily glucocorticoid dosage (15.5 ±9 vs. 6.9 ±7 mg/day prednisone-equivalent, P= 0.036), as compared to the other patients.
Conclusion
Older age and high-dose glucocorticoid therapy are associated with an increased risk of severe pyogenic infection during infliximab therapy. Caution is in order when starting and monitoring infliximab therapy in patients with risk factors. Our data also emphasize the need for a careful search for risk factors before each infliximab infusion.
© 2004 Elsevier SAS. Tous droits réservés.
Mots clés : Anti-TNFa ; Polyarthrite rhumatoïde ; Spondylarthrite ankylosante ; Effets indésirables ; Infections à pyogènes
Keywords : Anti-TNFa; Rheumatoid arthritis; Ankylosing spondylitis; Side effects; Pyogenic infections
Introduction
 L’infliximab représente une grande avancée thérapeutique dans le traitement de la polyarthrite rhumatoïde (PR)[1-3], et depuis peu de la spondyloarthrite (SPA) [4–7]. Cette molécule est en général bien tolérée [8,9], avec cependant quelques effets indésirables potentiels, en particulier infectieux [10,11]. Les données de la littérature insistent tout particulièrement sur les infections opportunistes, et mycobactériennes [12,13]. De ce fait, les cliniciens sont particulièrement avertis de ce risque, et certaines stratégies préventives ont été proposées [14], en particulier en ce qui concerne le risque tuberculeux, avant mise en route d’un traitement par infliximab.
L’infliximab représente une grande avancée thérapeutique dans le traitement de la polyarthrite rhumatoïde (PR)[1-3], et depuis peu de la spondyloarthrite (SPA) [4–7]. Cette molécule est en général bien tolérée [8,9], avec cependant quelques effets indésirables potentiels, en particulier infectieux [10,11]. Les données de la littérature insistent tout particulièrement sur les infections opportunistes, et mycobactériennes [12,13]. De ce fait, les cliniciens sont particulièrement avertis de ce risque, et certaines stratégies préventives ont été proposées [14], en particulier en ce qui concerne le risque tuberculeux, avant mise en route d’un traitement par infliximab.
Des infections à pyogènes ont également été décrites [15–18]. Le plus souvent, il s’agit d’infections bénignes mais, dans certains cas, le pronostic vital peut être menacé. Il n’existe toutefois pas de données montrant une augmentation du risque d’infection sévère à pyogène sous traitement. Il estégalement difficile à l’heure actuelle de savoir si ces infections sont plus sérieuses chez les patients traités, et si elles surviennent sur des terrains particuliers. Ceci explique probablement que, bien que certains auteurs aient proposé des stratégies préventives, par exemple une vaccination antipneumococcique [19], ces stratégies ne soient pas codifiées de manière aussi précise que pour le risque tuberculeux. Ainsi, un consensus international récemment publié se contente de considérer qu’il ne faut pas débuter le traitement (ou le stopper si il est cours) en cas d’infection sévère, telle que arthrite septique, ostéomyélite, abcès aigu, infection sur prothèse, sepsis, … [20]. Le RCP quant à lui précise que le traitement « est contre indiqué chez les patients présentant des infections sévères telles que sepsis, abcès, tuberculose, et infections opportunistes », et que « le traitement doit être interrompu si un patient développe une infection grave ou un sepsis ». La British Society for Rheumatology est un peu plus précise dans ses recommandations [21], en considérant que les contre-indications comportent les patients à haut risque infectieux, comprenant en particulier ceux avec des ulcères chroniques de jambe, ceux ayant présenté une arthrite septique ou une infection sur prothèse au cours de l’année précédente (ou dans les antécédents si la prothèse infectée est toujours en place), ceux ayant des antécédents d’infections pulmonaires récidivantes ou récurrentes.
En somme, les données scientifiques concernant les infections sévères à pyogènes sous infliximab sont parcellaires, notamment en ce qui concerne le terrain favorisant, et les recommandations en ce qui concerne leur prévention sont souvent peu précises. Par ailleurs, ces infections sont moins médiatisées que les infections tuberculeuses. Il n’est donc pas impossible que les cliniciens soient moins avertis du risque, et le prennent moins en compte que le risque tuberculeux au moment de l’appréciation de la balance bénéfice- risque, avant initiation du traitement.
Peu de temps après la mise sur le marché de l’infliximab en France, un réseau hospitalier s’est mis en place en Bourgogne, visant à suivre de façon standardisée les patients traités. Bien que le recueil des facteurs de risque d’infection à pyogène ne fasse pas partie de la feuille de collecte des données, l’analyse des patients inclus dans ce réseau peut apporter des renseignements utiles concernant ce risque septique, compte tenu du caractère exhaustif des inclusions, de la standardisation du recueil de données, de la nature multicentrique de la cohorte. En conséquence, un travail a été entrepris afin d’apprécier la prévalence des infections sévères à pyogènes chez les patients traités par infliximab en pratique courante, et essayer de dégager des facteurs ayant pu favoriser l’apparition de ce type d’infection.
Méthodes
Ce travail a concerné les patients traités par infliximab pour PR ou SPA dans un des hôpitaux participant au réseau régional bourguignon de prise en charge des rhumatismes inflammatoires par biothérapie iv.
Ce réseau regroupe les services hospitaliers des hôpitaux de Bourgogne où exerce un ou plusieurs rhumatologues, à temps plein ou non (Auxerre, Avallon, Chalon sur Saône, Dijon, Le Creusot, Mâcon, Montceau les Mines, Nevers, Sens). Ses objectifs principaux sont de standardiser la prise en charge et le suivi des patients sous infliximab. Pour ce faire, les praticiens des différents services concernés utilisent des fiches d’observation standardisées, remplies avant chaque perfusion, où figurent des informations sur l’activité de la maladie (notamment les variables permettant de calculer le DAS28), la thérapeutique (doses administrées d’infliximab, posologies des co-traitements éventuels par méthotrexate et corticoïdes), et la tolérance du traitement.
Pour chaque patient, les variables suivantes ont été recueillies : âge, sexe, indication du traitement par infliximab, nombre total de perfusions effectuées en novembre 2003, la poursuite ou non du traitement par infliximab et, en cas d’arrêt, la cause de celui-ci, l’existence d’une corticothérapie associée avec la dose de corticoïdes lors de la première perfusion d’infliximab, l’existence d’un terrain à risque infectieux, en particulier un diabète. À l’intérieur de la cohorte de patients suivis dans ce réseau, les observations de malades ayant présenté entre la mise sur le marché de la spécialité jusqu’à novembre 2003 une infection à pyogène grave sous infliximab ont été sélectionnées et analysées. Une infection à pyogènes a été définie comme une infection documentée sur le plan bactériologique, ou un tableau évocateur sur les plans clinique, de l’imagerie, et des examens de laboratoire, avec efficacité de l’antibiothérapie probabiliste. Une infection grave a été définie comme une infection ayant provoqué une hospitalisation, une prolongation d’hospitalisation, ou un décès. L’analyse statistique a été réalisée en plusieurs étapes. L’ensemble de la population a été décrite. Dans un second temps, les dossiers de patients ayant présenté une infection grave à pyogènes ont été analysés. Puis les sous-groupes avec ou sans infection grave à pyogènes ont été comparés par test de Mann-Whitney (âge, dose de corticoïdes associée) ou test exact de Fisher (sexe, indication de l’infliximab, association avec un diabète).
Résultats
Huit des neufs centres du réseau ont souhaité participer au travail. Au cours de la période évaluée, 83 patients (55 femmes, 28 hommes, d’âge moyen de 53,9 ± 13 ans) ont bénéficié d’un traitement par infliximab pour PR (60 patients, dont 48 femmes et 12 hommes, d’âge moyen de 57,2 ± 13 ans) ou SPA (23 patients dont 8 femmes et 15 hommes, d’âge moyen de 45,5 ± 10 ans).
La dose de la corticothérapie orale au moment de l’introduction de l’infliximab était de 9,3 ± 7 mg d’équivalent prednisone chez les patients atteints de PR, et de 2,6 ± 5 mg d’équivalent prednisone chez ceux atteints de SPA. Un diabèteétait associé à l’affection rhumatologique chez cinq des patients.
Au cours du suivi (médiane = 1 an), le traitement a été stoppé dans 36,1 % des cas (30 patients) pour résistance primaire ou secondaire (12 patients, tous atteints de PR), effet indésirable (12 patients, dont 4 infections et 6 réactions allergiques), décès sans rapport avec le traitement et non liés à une infection (2 patients), désir de grossesse (une patiente), autres (3 patients). Les données obtenues chez ces 30 patients ont été incluses dans les résultats.
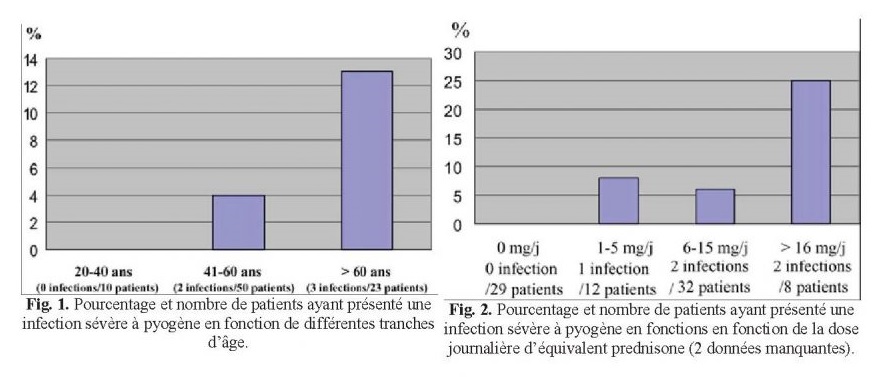
Cinq patients ont présenté une infection sévère à pyogène, soit une prévalence de 6%(taux de 5,5/100 patient–année). Il s’agissait de trois femmes et deux hommes, d’un âge moyen de 65,8 ± 12 ans, tous traités pour PR. Les cinq patientsétaient traités par corticothérapie, avec des doses journalières moyennes d’équivalent prednisone à l’instauration de l’infliximab et au moment de l’infection de respectivement 15,5± 9 et 14 ± 10 mg. La posologie hebdomadaire de méthotrexateétait en moyenne de 15,5 ± 2 mg. Le délai de survenue du problème infectieux par rapport à l’initiation de l’infliximabétait bref (médiane 2 mois, extrêmes = 1 semaine– 8 mois).
Les infections étaient représentées par une surinfection bronchique sévère, ayant conduit à une hospitalisation en réanimation pneumologique, une pneumopathie lobaire aiguë, un érysipèle, une septicémie sur pyélonéphrite, une septicémie avec spondylodiscite infectieuse. Les cultures de crachats montraient la présence d’un Hemophilus influenzae dans le premier cas, les hémocultures et la bactériologie urinaire retrouvaient la présence d’E. coli dans le quatrième cas, et les hémocultures mettaient en évidence un Staphylococcus aureus dans le cinquième cas. Pour les deux autres malades, le diagnostic d’infection à pyogène était retenu sur le tableau clinique et paraclinique, et sur l’évolution sous traitement antibiotique. Chez tous les patients, on retrouvait un terrain et/ou facteur favorisant. Tous étaient traités par corticoïdes, à doses relativement conséquentes. Les deux patients ayant fait une infection respiratoire étaient porteurs d’une bronchopneumopathie chronique obstructive (BPCO). De surcroît, le deuxième avait bénéficié de trois perfusions de 250 mg de solumédrol quelques jours avant la perfusion d’infliximab (dose non prise en compte dans la moyenne de la posologie de la corticothérapie donnée plus haut). Chez letroisième patient, l’érysipèle est apparu peu de temps après une perfusion d’infliximab, et était centré sur le point de ponction intraveineuse. Le quatrième patient était porteur d’un diabète. Enfin, la septicémie et la spondylodiscite staphylococcique sont survenues chez une patiente qui avait bénéficié d’une perfusion d’infliximab alors qu’elle présentait un cor au pied ulcéré et surinfecté, qu’elle avait oublié de signaler et qui était passé inaperçu à l’examen clinique.
L’évolution a été favorable sous antibiothérapie dans tous les cas. Toutefois, la patiente traitée pour surinfection bronchique sur BPCO a présenté dans l’année suivante, malgré l’arrêt de l’infliximab, trois nouvelles surinfections bronchiques, dont la dernière fatale. L’infliximab a été arrêté définitivement chez trois des cinq patients, et repris à distance de l’infection chez les deux autres. Pour l’un d’entre eux, il a duêtre stoppé quelques semaines plus tard pour réaction allergique.
Pour l’autre, les perfusions étaient poursuivies sans problème au moment de la collecte des données, soit un an après l’infection.
La comparaison entre les groupes ayant ou n’ayant pas présenté d’infection grave à pyogène n’a pas en évidence de différence en ce qui concerne le sexe, l’affection rhumatologique (PR ou SPA) et la présence d’un diabète. En revanche, les patients ayant présenté une infection étaient plus âgés que les autres (65,8 ± 12 ans contre 53,1 ± 13 ans, p = 0,043), etétaient traités par une dose plus importante de corticoïdes oraux (15,5 ± 9 contre 6,9 ± 7 mg d’équivalent prednisone par jour, p = 0,036) au moment de l’introduction de l’infliximab. Les Figs. 1,2 montrent les risques en fonction de l’âge et de la dose journalière de corticoïdes.
Discussion
Cette étude a retrouvé une prévalence d’infections sévères à pyogènes de 6 % chez les patients traités par infliximab pour rhumatisme inflammatoire chronique. Il a également été noté que tous les patients ayant présenté ce type d’infection présentaient au moins un facteur de risque associé.
Le principal défaut du travail est représenté par son caractère rétrospectif. De ce fait, certaines données ont été collectées de façon prospective, car incluses dans la feuille de suivi standardisée, mais d’autres ont été obtenues a posteriori. En conséquence, pour ces dernières, il n’a pas été possible de réaliser une comparaison entre les groupes ayant présenté ou non une infection sévère à pyogènes.
Bien qu’à première vue, la prévalence des infections sévères ait été comparable à celles observées dans les grandes études cliniques randomisées, cette prévalence tendait en faità être plus importante dans la présente cohorte. En effet, dans les grandes études type ATTRACT [22], les chiffres de prévalence concernent généralement l’ensemble des infections sévères, et non pas uniquement les infections à pyogène. Par ailleurs, il s’agit de chiffres globaux, qui tendent en fait à être un peu différents selon les sous-groupes. Ainsi, dans ATTRACT, le pourcentage global de patients ayant présenté une infection sévère sous infliximab était de 6 %, mais il n’était que de 2%chez les sujets traités à doses de 3 mg/kg toutes les huit semaines, ce qui correspond au protocole utilisé chez la majorité des patients de la présente étude. Dans l’étude ACCENT [23], effectuée chez des patients atteints de maladie de Crohn, la prévalence des infections sévères était de 3 à 4 %. Les études de cohorte retrouvent quant à elles des chiffres variables, allant de 0 à 18 %. Il convient toutefois d’être prudent dans les comparaisons avec les études randomisées et avec les autres études de cohorte. En effet, il est bien connu que les critères d’inclusion ou de non-inclusion dans les études thérapeutiques conduisent à inclure des populations qui peuvent présenter des caractéristiques un peu différentes de celles traitées en pratique courante. Par ailleurs, il est difficile de comparer des populations issues de cohortes différentes, qui ne sont pas forcément homogènes, les habitudes de prescription ou de suivi pouvant varier en fonction des praticiens ou des pays. Ainsi, à définition d’infection sévère identique, on relève qu’un patient canadien n’a pas été hospitalisé malgré une pneumopathie [24], alors qu’il l’aurait peut-être été dans la présente cohorte. À l’inverse, le patient bourguignon hospitalisé pour érysipèle ne l’aurait peut-être pas été partout.
Enfin, il convient de se rappeler que la présente étude est une étude non comparative, et qu’elle ne permet donc en aucune manière de comparer la prévalence des infections sévères à pyogènes chez les patients traités ou non par infliximab. Les patients traités présentaient en effet une affection sévère, invalidante, traitée dans deux tiers des cas par corticoïdes. On sait qu’il existe une augmentation du risque septique chez les patients atteints de PR traités par doses conséquente de corticoïdes [25]. Il existait donc probablement un biais de recrutement, avec traitement proposé chez des sujets fragilisés, et augmentation basale du risque septique.
Dans cette étude, on note que les infections sont survenues de façon précoce. Ceci n’avait pas été noté dans une cohorte belge de 107 patients traités pour spondylarthrite ankylosante [26]. En revanche, dans une cohorte hollandaise de 230 patients atteints de polyarthrite rhumatoïde traités par anti-TNF, dont 120 traités par infliximab, plus de la moitié des infections sévères étaient survenues au cours de la première année de traitement [27]. Il paraît donc important d’être particulièrement attentif au risque infectieux au cours des premiers mois de traitement.
Par ailleurs, outre le terrain probablement plus fragile de la population dans son ensemble signalé plus haut, on note avec intérêt que tous les patients ayant souffert d’une infection sévère à pyogènes présentaient au moins un facteur de risque pour ce type de problème. Ces facteurs de risques pouvaient être divisés en deux parties : les co-morbidités, en particulier le diabète et surtout la BPCO ; les facteurs de risque ponctuels. La méthodologie utilisée ne permet pas d’affirmer que la BPCO était plus fréquemment rencontrée chez les patients ayant souffert d’une infection sévère à pyogènes. On peut toutefois se demander si il ne faut pas être plus prudent dans les indications chez les patients présentant une telle co-morbidité. On est en particulier troublé par le fait que les deux patients ayant souffert d’une surinfection broncho-pulmonaire étaient porteurs d’une BPCO sousjacente bien stabilisée, sans notion de surinfections récentes ou fréquentes, et la question du rapport de cause à effet peut être soulevée. Cette possible augmentation du risque de surinfection bronchopulmonaire chez les patients porteurs de BPCO est d’autant plus importante à noter que cette affection est oubliée dans la plupart des recommandations. En effet, en général, celles-ci citent sans autre précision les affections où le risque infectieux est augmenté.
La notion de facteurs de risques ponctuels semble particulièrement importante. En effet, dans certains cas, ce facteur favorisant aurait pu être éliminé. Ceci est notamment illustré par la patiente ayant présenté une septicémie avec spondylodiscite infectieuse, dont le point de départ était un cor au pied surinfecté, ou par l’observation du patient ayant reçu des perfusions de solumédrol quelques jours auparavant. Par conséquent, l’éducation du patient et du médecin est primordiale, d’autant plus que l’utilisation des anti-TNFa se généralise, et il est nécessaire de ne pas banaliser ces traitements. Il convient d’attirer régulièrement l’attention du patient sur ce risque, et de réévaluer avant chaque perfusion le risque infectieux chez les patients, en pratiquant notamment un interrogatoire et un examen clinique complets.
Enfin, les résultats concernant l’augmentation du risque avec l’âge et avec les doses de corticoïdes ne sont pas très surprenants. Il convient de rappeler que ce travail n’est pas comparatif. Des taux similaires d’infections auraient peut être été observés dans les mêmes sous-populations, non traitées par infliximab. Par ailleurs, en ce qui concerne les corticoïdes, on ne peut pas exclure une diminution du risque potentiel compte tenu de l’épargne cortisonée souvent obtenue grâce à l’infliximab. Cependant, bien que ce travail ne permette donc pas de l’affirmer, il conviendrait peut être d’être prudent dans les indications d’infliximab chez les sujets âgés ou chez ceux traités par hautes doses de corticoïdes.
Enfin, on note que tous les patients ayant présenté une infection sévère à pyogènes étaient traités pour PR. Toutefois, la variable maladie sous-jacente n’était associée statistiquement au risque. Par ailleurs, les patients atteints de PRétaient plus âgés, et étaient traités en moyenne par des doses plus importantes de corticoïdes que ceux atteints de SPA, ce qui pourrait expliquer le déséquilibre observé entre PR et SPA dans cette étude. D’autres travaux, de puissance statistique supérieure, seraient utiles pour confirmer cet élément*.
* Depuis que l’article a été écrit, une mise à jour des recommandations de la British Society for Rheumatology est parue [28], dans laquelle on retrouve qu’il pourrait y avoir une augmentation de la mortalité chez les patients présentant une fibrose pulmonaire traités par infliximab que, malgré un manque de données, cette augmentation pourrait exister avec d’autres agents biologiques et que, en attendant d’en savoir plus, il faut prendre des précautions quand on traite ces patients par anti-TNF states, et il faut les suivre avec soin notamment sur le plan infectieux et sur le plan de la fonction respiratoire.
Remerciements
Remerciements aux autres médecins du réseau bourguignon : C. Bressot, A. Cherasse, J.A. Dellas, J. Dupuis, M. Falconnet, L. Julien, F. Marchand, N. Richard, C. Sidot.
Références
- [1] Harriman G, Harper LK, Schaible TF. Summary of clinical trials in rheumatoid arthritis using infliximab, an anti-TNFa treatment. AnnRheum Dis 1999;58(suppl I):I61–I64.
- [2] Hochberg MC, Tracy JK, Flores RH. “Stepping-up” from methotrexate: a systematic review of randomised placebo controlled trials in patients with rheumatoid arthritis with an incomplete response to methotrexate. Ann Rheum Dis 2001;60(Suppl 3):iii51– iii54.
- [3] Lipsky PE,Van der Heijde DM, St ClairEW, Furst DE, Breedveld FC, Kalden JR, et al. Infliximab and methotrexate in the treatment of
rheumatoid arthritis. Anti-Tumor Necrosis Factor Trial in Rheumatoid Arthritis with Concomitant Therapy Study Group. N Engl J Med 2000;343:1594–602. - [4] Brandt J, Sieper J, Braun J. Infliximab in the treatment of active and severe ankylosing spondylitis. Clin Exp Rheumatol 2002;20(Suppl 28):S106–S110.
- [5] Braun J, Brandt J, Listing J, Zink A, Alten R, Burmester G, et al. Long-term efficacy and safety of infliximab in the treatment of ankylosing spondylitis: an open, observational, extension study of a threemonth, randomized, placebo-controlled trial. Arthritis Rheum 2003; 48:2224–33.
- [6] Schnarr S, Kuipers JG, Zeidler H. Anti-tumour necrosis factor (TNF)-a therapy in undifferentiated spondyloarthropathy. Clin Exp Rheumatol 2002;20(Suppl 28):S126–S129.
- [7] Temekonidis TI,AlamanosY, Nikas SN, Bougias DV, Georgiadis AN, Voulgari PV, et al. Infliximab therapy in patients with ankylosing
spondylitis: an open label 12 month study. Ann Rheum Dis 2003;62: 1218–20. - [8] Schaible TF. Traitement de maladies inflammatoires : sécurité d’emploi à long terme de l’infliximab. Press Med 2001;30:610–23.
- [9] Shergy WJ, Isern RA, Cooley DA, Harshbarger JL, Huffstutter JE, Hugues GM, et al. Open label study to assess infliximab safety and
timing of onset of clinical benefit among patients with rheumatoid arthritis. J Rheumatol 2002;29:667–77. - [10] Day R. Adverse reactions to TNF-alpha inhibitors in rheumatoid arthritis. Lancet 2002;359:540–1.
- [11] Weisman MH. What are the risks of biologic therapy in rheumatoid arthritis? An update on safety. J Rheumatol 2002;29(Suppl 65):33–8.
- [12] Gomez-Reino JJ, Carmona L, Valverde VR, Mola EM, Montero MD. Treatment of rheumatoid arthritis with tumor necrosis factor inhibitors may predispose to significant increase in tuberculosis risk: a multicentre-active surveillance report. Arthritis Rheum 2003;48:
2122–7. - [13] Roth S, Delmont E, Heudier P, Kaphan R, Cua E, Castela J, et al. Anticorps anti-TNFa (infliximab) et tuberculose: à propos de trois
cas. Rev Med Interne 2002;23:312–6. - [14] GTI (Groupe Tuberculose et Infliximab), Afssaps. Recommendations about the prevention and management of tuberculosis in patients taking infliximab. Joint Bone Spine 2002;69:170–2.
- [15] Harney S, O’Shea FD, Fitzgerald O. Peptostreptococcal pericarditis complicating anti-tumour necrosis factor alpha treatment in rheumatoid arthritis. Ann Rheum Dis 2002;6:653–4.
- [16] Kroesen S, Widmer AF, Tyndall A, Hasler P. Serious bacterial infections in patients with rheumatoid arthritis under anti-TNF-alpha
therapy. Rheumatology 2003;42:617–21. - [17] Matzkies FG, Manger B, Schmitt-Haendle M, Nagel T, Kraetsch HG, Kalder JR, et al. Severe septicaemia in a patient with polychondritis and Sweet’s syndrome after initiation of treatment with infliximab. Ann Rheum Dis 2003;62:81–2.
- [18] Olivieri I, Padula A, Armignacco L, Sabatella V, Mancino M. Septic arthritis caused by moraxella catarrhalis associated with infliximab treatment in a patient with undifferentiated spondarthritis. Ann Rheum Dis 2004;63:105–6.
- [19] Ellerin T, Rubin RH,Weinblatt ME. Infections and anti-tumor necrosis factor alpha therapy. Arthritis Rheum 2003;48:3013–22.
- [20] Furst DE, Breedveld FC, Kalden JR, Smolen JS, Burmester GD, Dougados M, et al. Updated consensus statement on biological agents for the treatment of rheumatoid arthritis and other immune mediated inflammatory diseases (may 2003). Ann Rheum Dis 2003;62(suppl 2):ii2–ii9.
- [21] British Society for Rheumatology. Guidelines for prescribing TNF-a blockers in adults with rheumatoid arthritis: report of a working party of the british society for rheumatology. www.msecportal.org/portal/editorial/PublicPages/bsr/536883013/1.doc.
- [22] Maini R, St Clair EW, Breedveld F, Furst D, Kalden J, Weisman M, et al. Infliximab (chimeric anti-tumour necrosis factor a monoclonal antibody) versus placebo in rheumatoid arthritis patients receiving concomitant methotrexate: a randomised phase III trial. Lancet 1999; 354:1932–9.
- [23] Hanauer SB, Feagan BG, Lichtenstein GR, Mayer LF, Schreiber S, Colombel JF, et al. Maintenance infliximab for Crohn’s disease: the ACCENT I randomised trial. Lancet 2002;359:1541–9.
- [24] Doran MF, Crowson CS, Pond GR, O’Fallon WM, Gabriel SE. Predictors of infection in rheumatoid arthritis. Arthritis Rheum 2002;46:2294–300.
- [25] Fitzcharles MA, Clayton D, Menard HA. The use of infliximab in academic rheumatology practice: an audit of early clinical experience. J Rheumatol 2002;29:2525–30.
- [26] Baeten D, Kruithof E, Van den Bosch F, Van den Bossche N, Herssens A, Mielants H, et al. Systematic safety follow up in a cohort of 107 patients with spondyloarthropathy treated with infliximab: a new perspective on the role of host defense in the pathogenesis of the disease? Ann Rheum Dis 2003;62:829–34.
- [27] Flendrie M, Creemers MC, Welsing PM, Den Broeder AA, Van Riel PL. Survival during treatment with tumour necrosis factor blocking agents in rheumatoid arthritis. Ann Rheum Dis 2003;62(suppl 2):ii30–ii33.
- [28] Update with rheuma https://wwwNFforRAguid. H. Maillard et al. / Revue du Rhumatisme 72 (2005) 650–655 65